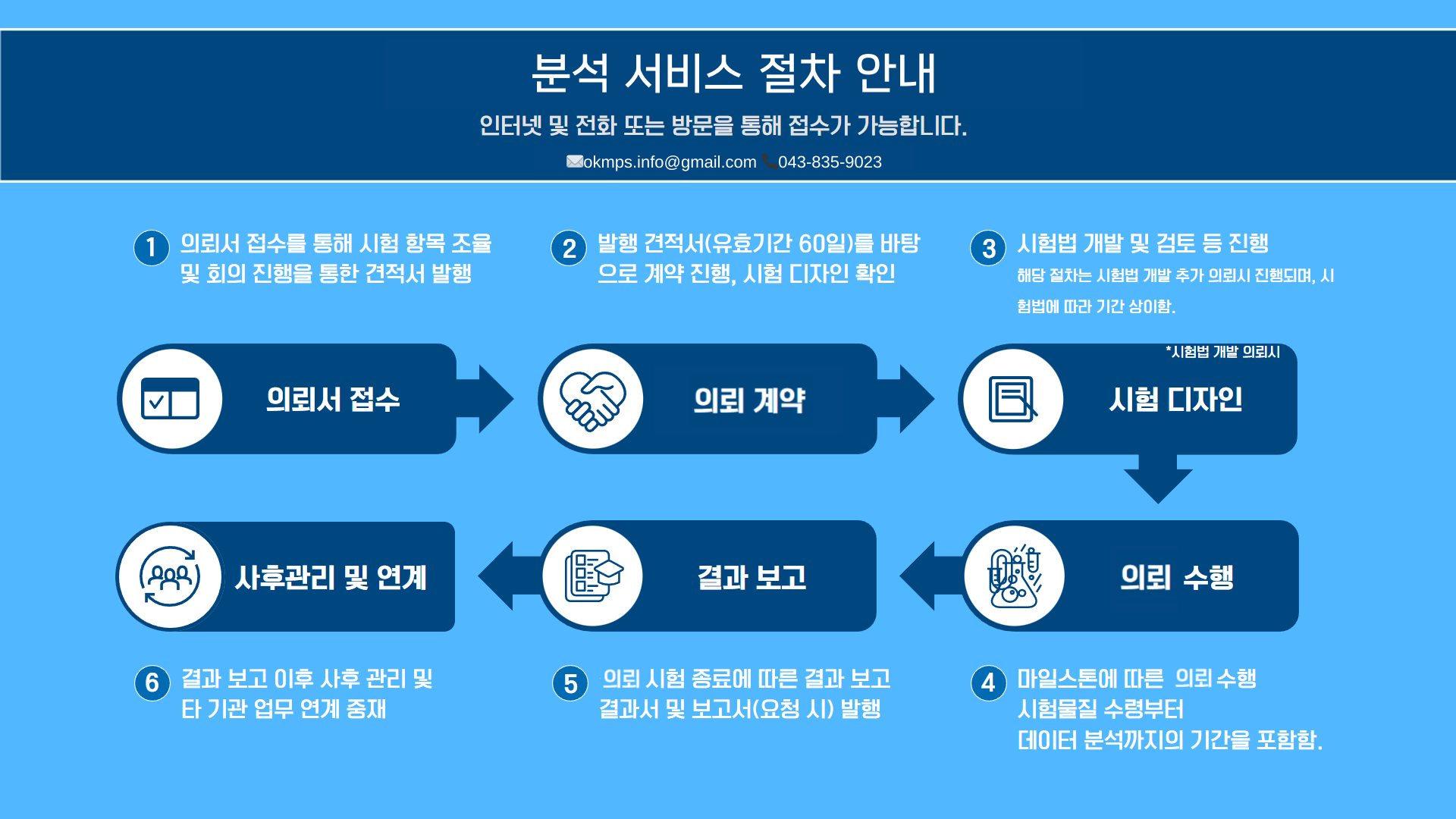
A–CAE: Adverse Event, 이상사례.API: Active Pharmaceutical Ingredient, 원료의약품.APR / PQR: Annual Product Review / Product Quality Review, 연간 제품(품질)평가.AR: Analytical Report 또는 Analytical Result, 시험 성적서/결과.Batch: 동일 조건에서 제조·가공된 특정 수량의 제품.BMR / MBR: Batch Manufacturing Record / Master Batch Record, 배치제조기록 / 기준배치기록.BPR: Batch Packaging Record, 배치포장기록.CAPA: Corrective and Preventive Action, 시정 및 예방조치.CFR: C..