모어법(Mohr’s Method)을 이용한 염화물 이온 농도 결정은 화학적 정량분석에서 가장 전통적이면서도 정밀도가 높은 침전적정법 중 하나로, 특히 수질 분석이나 식품, 제약, 환경 분야에서 널리 사용된다. 이 방법은 질산은(AgNO₃)을 표준용액으로 사용하여 용액 속의 염화이온(Cl⁻)을 정량적으로 결정하는 것이 핵심이다. 실험의 원리, 반응식, 조건, 주의사항, 그리고 계산 절차까지 단계별로 이해하면 실험적 오차를 최소화하고 매우 정확한 결과를 얻을 수 있다.
모어법의 원리와 반응 과정
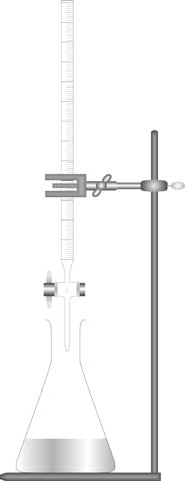
모어법의 핵심은 은 이온(Ag⁺)과 염화이온(Cl⁻)이 만나 불용성 염화은(AgCl) 침전을 형성하는 반응에 있다. 이 반응은 다음의 화학식으로 나타난다.
Ag⁺(aq) + Cl⁻(aq) → AgCl(s)
이 반응은 매우 빠르고 완결성이 높아, 시료 속 염화이온이 모두 반응한 순간을 종말점으로 판단할 수 있다. 그러나 AgCl 침전은 흰색으로 색 변화가 뚜렷하지 않아, 종말점을 육안으로 확인하기 어렵다. 이 문제를 해결하기 위해 지시약으로 크롬산칼륨(K₂CrO₄)을 사용한다. 염화이온이 모두 반응한 이후 추가된 은 이온은 지시약의 크롬산이온(CrO₄²⁻)과 반응하여 적갈색의 크롬산은(Ag₂CrO₄)을 생성한다.
2Ag⁺(aq) + CrO₄²⁻(aq) → Ag₂CrO₄(s)
이때 처음으로 적갈색 침전이 관찰되는 시점이 적정의 종말점이다. 흰색의 AgCl 침전 위에 미세한 적갈색이 나타나는 순간을 정확히 구별해야 하므로, 관찰자는 세심한 주의를 기울여야 한다.
실험 조건의 중요성: pH 조절
모어법은 단순한 침전반응처럼 보이지만, 반응의 정확성을 위해서는 용액의 pH가 매우 중요하다. 실험용 시료의 pH는 반드시 6.5에서 10 사이를 유지해야 한다.
pH가 6.5 이하로 낮아지면, 크롬산이온이 HCrO₄⁻ 또는 Cr₂O₇²⁻ 형태로 변환되어 지시약의 색 변화가 불명확해진다. 반대로 pH가 10 이상으로 높아지면, 은 이온이 수산화이온(OH⁻)과 반응하여 AgOH 침전을 형성하게 되어 적정 결과에 오차가 발생한다.
따라서 중성 또는 약알칼리 상태를 유지해야 하며, 필요 시 완충용액을 사용할 수 있다. 만약 시료가 산성이라면 모어법 대신 볼하드법(Volhard’s method)이나 중량법을 사용하는 것이 바람직하다.
시약 준비와 실험 절차
실험은 시료 정제부터 시작된다. 해수나 하천수 등의 시료는 고형물, 모래, 해조류 등을 제거하기 위해 반드시 여과 과정을 거쳐야 한다. 그 후 여과된 시료 20 mL를 피펫으로 정확히 취하여 100 mL 용량플라스크에 넣고 증류수로 표선까지 채워 희석한다.
이 희석 용액 10 mL를 다시 피펫으로 취해 원추형 플라스크에 옮기고, 여기에 증류수 약 50 mL와 1 mL의 크롬산칼륨 지시약을 첨가한다. 준비된 용액은 희미한 레몬색을 띠게 된다.

적정은 0.1 mol/L 농도의 질산은 용액을 사용한다. 뷰렛을 통해 질산은 용액을 천천히 떨어뜨리면 흰색 AgCl 침전이 형성된다. 적정을 계속하면 어느 순간 용액 전체가 처음에는 흐린 노란색이었다가, 종말점 부근에서 뚜렷한 적갈색으로 변한다. 이때 즉시 적정을 멈추어야 한다.

정확성을 위해 동일한 시료를 여러 번 반복적으로 적정하여, 질산은 용액 소비 부피가 0.1 mL 이내에서 일치하는 값을 얻는 것이 이상적이다. 이를 일치값(concordant results)이라 하며, 이 평균값이 계산에 사용된다.

결과 계산과 해석
적정에서 사용된 질산은 용액의 평균 부피(V, L)와 농도(C, mol/L)를 이용해 반응한 은 이온의 몰 수를 구한다.
n(Ag⁺) = C × V
앞서 반응식에서 알 수 있듯이, 은 이온과 염화이온의 반응비는 1:1이다. 따라서 염화이온의 몰 수도 동일하다.
n(Cl⁻) = n(Ag⁺)
이 값을 시료 부피로 나누면 희석된 시료의 염화이온 농도를 구할 수 있고, 이어서 희석 배율을 곱하여 원본 시료(해수)의 염화이온 농도로 환산한다.
필요에 따라 이 농도를 염화나트륨(NaCl) 기준으로 환산해 mol/L, g/L, 또는 g/100 mL 단위로 보고한다.
안전 수칙과 폐기물 처리
모어법에 사용되는 크롬산칼륨 용액은 6가 크롬 화합물로 발암성이 있는 물질이다. 따라서 반드시 장갑, 보안경, 실험복, 밀폐된 신발을 착용해야 한다.
질산은 역시 강한 산화제이자 부식성이 강한 화학물질로, 피부나 옷에 닿으면 화학 화상을 입거나 검은 얼룩이 남을 수 있다. 흘렸을 경우 즉시 다량의 물로 씻어야 하며, 오염된 천은 폐기해야 한다.
실험이 끝난 후에는 Ag⁺가 포함된 폐액을 일반 하수구에 버리지 않고, 은 회수용 폐액통에 모아 금속 회수 처리해야 한다.

추가 고려 사항
모어법은 염화이온 외에도 브롬화이온(Br⁻)에 반응하기 때문에, 시료 내 브롬화물 농도가 높으면 결과가 부정확해질 수 있다. 그러나 일반적인 해수에서는 브롬화물의 농도가 매우 낮아 실험 결과에 큰 영향을 주지 않는다.
또한 본 실험을 처음 수행하는 경우, 실제 적정 전 예비 적정(rough titration)을 한 번 진행하여 색 변화 시점을 미리 익혀두는 것이 좋다.
모어법은 19세기 초 화학자 Karl Friedrich Mohr에 의해 개발된 이후, 오늘날까지도 수질 분석의 표준 방법으로 자리 잡고 있다. 단순한 화학 반응 속에 정량적 사고와 시각적 판단의 정교함이 공존하는 실험이다. 시료의 성질, pH, 지시약 반응, 폐액 처리까지 모두 통제해야만 신뢰할 수 있는 결과를 얻을 수 있다.
2025.06.03 - [COFFEEPHARM QCLAB ] - About Us
About Us
커피 한 잔에도 믿음이 필요하다고 느낀 적 있는가. 예쁜 카페, 감성적인 분위기, 고급 원두라는 말은 흔하다. 하지만 정말 이 커피가 어디서, 어떻게 만들어졌고, 내가 마신 이 맛이 다음에 와도
qclab.kr
'품질관리(Quality Control) > 이화학' 카테고리의 다른 글
| 건조물(dry basis)과 무수물(anhydrous basis)의 정량 계산 차이 As is 품질관리 실무 종결 (0) | 2025.10.29 |
|---|---|
| 폴리소르베이트80 지방산 성분함량비 실무 대한민국약전 (KP) 시험법 (1) | 2025.10.29 |
| 건조감량과 강열잔분 시험의 '항량' 기준 해석과 실무 적용 방법 (1) | 2025.10.22 |
| 수분 측정의 표준, 칼피셔 적정법의 원리와 실전 적용 (6) | 2025.10.21 |
| 적외선 분광법(IR spectroscopy) 확인시험 USP vs EP vs JP 차이 공정서 파일 공유 (1) | 2025.10.20 |
