바이오의약품 제조공정 밸리데이션 가이드라인
이 가이드라인은 현재까지의 축적된 경험과 과학적 사실에 근거한 것이므로 새로운 논리에 대한 과학적 타당성이 확인될 경우 언제든지 개정될 수 있습니다.
또한, 이 가이드라인에 기술된 내용은 권고사항으로 법적인 구속력을 갖지 않으며, 기존의 규정을 대체하지 않습니다. 제시된 방법은 최신의 규정과 과학 적 근거를 바탕으로 기술한 것으로 추후 규정 개정 및 과학의 발전으로 수정 될 수 있으며, 다른 대안 또는 더 나은 방법을 적용하고자 할 경우 과학적인 접근 방법에 따라 적절한 검증 및 근거를 마련한다면 다른 방법도 활용할 수 있습니다.
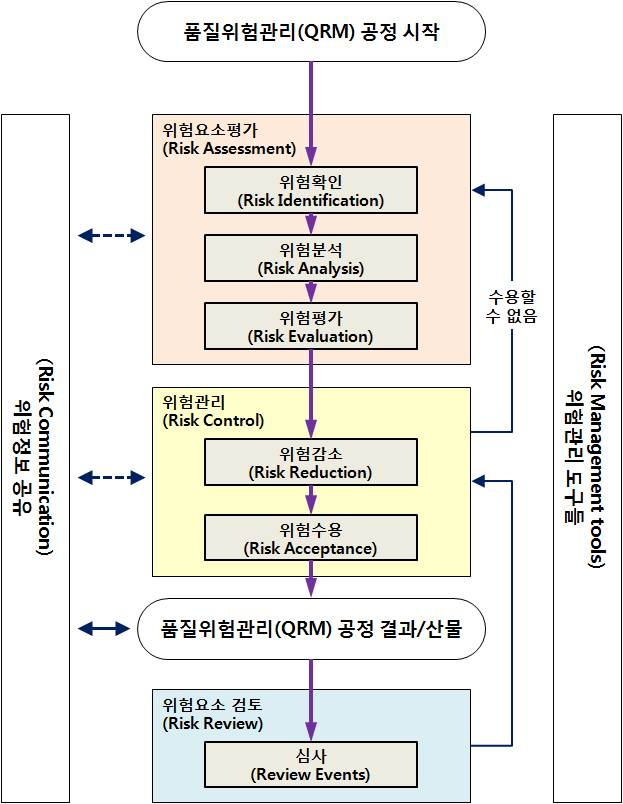
품질위험관리(QRM)의 분석방법
위험관리 절차에서 분석 방법에 사용되는 분석기법은 여러 가지가 있다. 그 목적 및 용도에 따라 흐름도(Flow Charts), 점검시트(Check Sheets), 프로세스 맵핑(Process Mapping), 원인-결과도(Cause and Effect Diagrams)를 포함한 기본적인 위험관리 분석방법을 사용 할 수 있다.
또한 상세적인 분석을 위해 FMEA(Failure Mode Effects Analysis), FMECA(Failure Mode, Effects and Criticality Analysis), FTA(Fault Tree Analysis), HACCP(Hazard Analysis and Critical Control Points), HAZOP(Hazard Operability Analysis), PHA(Preliminary Hazard Analysis), Risk Ranking and Filtering 등의 기법을 활용할 수 있다. 또한 관리도, 시험계획법, 히스토그램, 파레토차트, 공정능력분석 등의 전문적인 통계적 방법을 활용할 수도 있다.
'품질관리(Quality Control) > 밸리데이션' 카테고리의 다른 글
| 시험방법 밸리데이션 MV (method validation) 모의 예제 자동 계산 엑셀파일 공유 (0) | 2025.05.07 |
|---|---|
| 의약품 등 시험방법 밸리데이션 가이드라인 해설서 MV (1) | 2025.02.12 |
| 의약품 등 시험방법 밸리데이션에 대한 가이드라인 적용을 위한 해설서 (3) | 2025.02.12 |
| 분석방법의 method validation 기법 연구 (0) | 2025.01.30 |
| 분석법검증(Method Validation) 지침서 개발 연구 (0) | 2025.01.30 |
