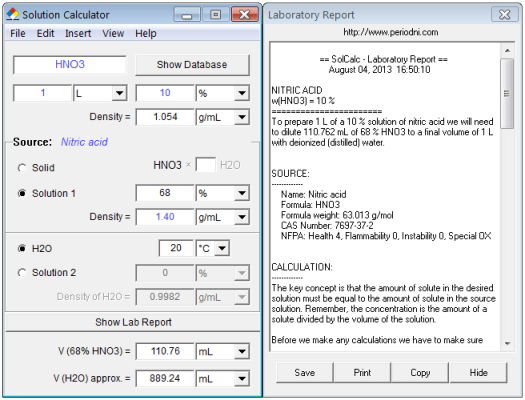
퍼센트 농도(wt%)를 몰농도(M)로 변환하는 공식은 겉으로 보기에 간단하지만, 그 안에는 두 가지 핵심적인 단위 변환이 숨어 있어. 우리가 흔히 사용하는 공식은 다음과 같지.몰농도(M) = (wt% / 몰질량) x 밀도 x 10이 공식에서 가장 궁금한 부분은 바로 마지막에 곱해지는 '10'이 왜 필요한가 하는 점일 거야. 이 숫자는 단순히 계산의 편의를 위해 붙은 것이 아니라, 퍼센트 농도와 몰농도 사이의 단위 차이를 메워주는 역할을 하고 있다. 퍼센트(%)를 소수로 전환하기 wt%는 용액 100g 속에 용질이 몇 g 들어 있는지를 나타낸다. 예를 들어, 35% 용액이라면 용액 100g에 용질이 35g 녹아 있다는 뜻이지. 이 35%를 수학적인 비율로 바꾸면 35÷100=0.35가 된다. 공식에 이 비..