이화학적동등성은 대조약과 시험약의 물리화학적 성질에 대한 시험 결과를 비교하여 판정한다. 이때 해당 평가항목이 제품의 품질, 안전성· 유효성에 미치는 영향과 시험방법 등을 종합적으로 고려하여 평가기준을 설정하되, 일반적으로 대조약 결과의 ±10% 이내로 설정하는 것이 바람직하다.
평가 항목 중 완충제 또는 완충력에 영향을 미치는 성분이 포함된 경우 완충력 시험을 진행한다.
이화학적 동등성 시험에서 완충력 시험을 하는 이유는 약물의 안정성 및 유효성을 보장하기 위함이다. 특히, pH 변화에 민감한 주사제, 점안제, 점이제와 같은 제형에서 완충력이 중요한 역할을 한다. 완충력 시험을 통해 시험 대상 약물과 대조 약물의 완충력이 유사함을 증명함으로써, 두 약물이 체내 환경에서 pH 변화에 동일하게 반응하고, 약효가 일관성 있게 유지될 수 있음을 확인한다.
USP-NF <1160> 15.2.3 Buffer Capacity
완충력 : 소량의 강산 또는 강염기 첨가 시 pH 변화에 저항하는 능력.
1L 용액의 pH 를 1 변화시키는 데 강산 또는 강염기 1g 당량 필요시 완충력은 1 임.
일반적으로 완충력 시험에는 훨씬 적은 양의 완충용액 사용.
완충력(Buffer capacity)
완충력(Buffer capacity, β)은 용액의 pH를 1만큼 변화시키는 데 필요한 강산 또는 강염기의 양을 의미하며, 이는 완충 용액이 외부로부터 가해지는 산이나 염기에 얼마나 잘 저항하는지를 나타내는 지표다.


(USP-NF 예시) 상세 추가 해설
0.25L 완충용액의 pH 를 0.5 변화시키는 데 NaOH 0.01g 당량 필요 시 완충력은 다음과 같이 계산됨
(0.01Eq/0.25L)/0.5 pH 변화 = 0.08 (Eq/L)/(pH 변화)
완충력()은 완충 용액이 외부로부터 유입되는 산이나 염기에 대해 얼마나 pH 변화에 저항하는지를 나타내는 정량적 지표이다. 완충력은 용액 1리터의 pH를 1 단위만큼 변화시키는 데 필요한 강산 또는 강염기의 몰(mole) 수로 정의된다.
완충력은 다음과 같은 공식으로 계산된다:
- : 용액 1L에 가해진 강염기 또는 강산의 농도 변화량 (mol/L)
- : 그로 인해 발생한 pH 변화량
주어진 문제의 조건은 다음과 같다.
- 완충 용액의 부피: 0.25L
- pH 변화량(): 0.5
- 첨가된 NaOH의 양: 0.01g 당량
우선, 완충력 계산을 위해서는 첨가된 NaOH의 양을 '몰(mol)' 단위로 환산해야 한다. NaOH의 화학식량은 약 40g/mol이므로, 0.01g 당량의 NaOH는 0.01mol과 같다. 이는 NaOH의 당량수(equivalent number)가 1이기 때문이다.
- 첨가된 NaOH 몰 수: 0.01mol
다음으로, 이 몰 수를 용액의 부피(0.25L)로 나누어 용액 1L당 몰수를 구해야 한다.
- 용액 1L에 대한 몰 농도 변화량 (): 0.01 mol / 0.25 L = 0.04 mol/L
이제 완충력 공식에 위에서 구한 값들을 대입한다.
따라서, 이 완충 용액의 완충력은 0.08이다. 이 값은 이 완충 용액 1L의 pH를 1만큼 변화시키기 위해 0.08mol의 강염기 또는 강산이 필요하다는 것을 의미한다. 완충력은 용액의 농도가 높을수록 커지며, pH와 pKa가 유사할 때 최대치를 나타낸다.
실제시험) 2mL 품목의 pH 를 1 변화시키는 데 0.1N(0.4g/100mL) NaOH 0.2mL 필요
(0.4g/100mL*0.2mL/0.002L)/1 pH 변화 = 0.4 (Eq/L)/(pH 변화)
- 용액의 부피: 2 mL
- pH 변화량: 1
- 첨가된 NaOH 용액의 농도: 0.1N (0.1M)
- 첨가된 NaOH 용액의 부피: 0.2 mL
우선, 0.2mL의 0.1N NaOH에 들어있는 NaOH의 몰수를 계산해야 한다.
다음으로, 이 몰수를 용액의 부피(2mL)로 나누어 용액 1L당 몰수를 구해야 한다.
이제 이 값을 완충 용량 공식에 대입하면,
Example Problem of Buffer Capacity
Problem:
We are given 600 mL of a sodium phosphate buffer with a pH of 7.39. We then add to it 150 mL of 0.2 M HCl. This addition gives the buffer solution a new pH of 7.03. What is the capacity of our sodium phosphate buffer?
Solution:
First, we find n by dividing the number of moles of HCl we added to the buffer by the initial volume of the buffer. Don’t for get your units, should be in liters!
Number of moles of HCl
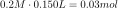
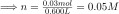
Then, following the formula, we divide n by the change in pH of the sodium phosphate solution.
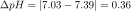
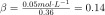
Thus, the buffer capacity of our sodium phosphate solution is 0.14.
완충력 시험의 세부 목적
- 약물의 안정성 확보: 대부분의 약물은 특정 pH 범위 내에서만 안정적으로 존재한다. pH가 이 범위를 벗어나면 약물이 분해되거나 침전되어 약효를 잃을 수 있으며, 독성 물질이 생성될 수도 있다. 완충력 시험은 약물 제제가 저장, 유통, 투여되는 과정에서 발생할 수 있는 pH 변화에 얼마나 잘 저항하는지를 평가한다. 이는 약물의 유효기간 동안 품질을 유지하는 데 필수적이다.
- 약물 투여 시 환자의 편의성 및 안전성 증진: 주사제나 점안제는 체내 또는 점막에 직접 투여되므로, 약물의 pH가 신체 내 환경과 크게 다르면 통증, 자극, 조직 손상 등의 부작용을 유발할 수 있다. 완충력이 적절한 약물은 체내 pH와 유사한 수준을 유지하며, 투여 후에도 급격한 pH 변화를 막아 환자의 불쾌감을 최소화하고 안전성을 높여준다.
- 생체 내 약물 흡수 및 작용의 일관성 보장: 약물의 용해도와 흡수는 pH에 따라 크게 달라질 수 있다. 특히 약산성 또는 약염기성 약물은 이온화 상태가 pH에 따라 변하며, 이는 약물의 막 투과성과 흡수에 직접적인 영향을 준다. 완충력 시험을 통해 두 약물이 체내 다양한 pH 환경(위, 장 등)에서 유사한 용해 및 흡수 패턴을 보일 것임을 예측할 수 있다. 이는 제네릭 의약품이 오리지널 의약품과 동일한 약효를 나타내는지 입증하는 중요한 근거가 된다.

완충용액의 완충력은 일반적으로 용액의 pH가 완충제의 pKa와 가까울수록 최대가 된다. 그러나 실제 의약품 품목에서는 허가된 주사제의 pH가 사용된 완충제의 pKa와 차이가 나는 경우가 많다. 예를 들어, 인산이수소나트륨과 인산수소나트륨을 완충제로 사용한 주사제의 pH가 5.5인데, 이 때 완충제의 pKa는 약 7로 실제 pH와 차이가 존재한다. 이런 상황에서는 단순히 pKa 근처에서 최적 완충력을 기대하기 어렵기 때문에, 시험 설계 시 실제 품목의 pH와 완충제의 특성을 모두 고려해야 한다.
이 사례에서는 완충력 시험을 수행할 때 강산(HCl)과 강염기(NaOH)를 각각 사용하여 실측한 결과를 비교하였다. HCl을 사용한 경우 0/11 Eq/ΔpH로 측정되어 완충력이 거의 나타나지 않았고, 반대로 NaOH를 사용한 경우 0.70 Eq/ΔpH로 비교적 유의한 완충력이 나타났다. 이는 주사제의 pH가 5.5로 완충제의 pKa(약 7)보다 낮기 때문에 산에 대한 저항력은 거의 없고, 염기에 대한 저항력이 상대적으로 크다는 사실을 보여준다.
즉, 완충력 시험 시 단순히 완충제의 pKa만 기준으로 강산·강염기를 선택하는 것은 적절하지 않다. 품목의 실제 pH를 기준으로, 용액이 실제 사용 환경에서 안정적인 pH를 유지할 수 있도록 강산이나 강염기 시험 조건을 조절하는 것이 바람직하다. 이를 통해 시험 결과가 품목의 실제 특성을 반영하고, 품질 및 안전성을 보다 정확하게 평가할 수 있다.
결론적으로, 완충력 평가는 단순한 공식 계산에 그치지 않고, 품목 pH와 완충제 pKa 차이를 고려하여 시험 조건과 산·염기 선택을 조정하는 과정이 핵심이다. 이를 통해 의약품의 pH 안정성을 과학적이고 실질적으로 검증할 수 있다.

2025.06.03 - [COFFEEPHARM QCLAB ] - About Us
About Us
커피 한 잔에도 믿음이 필요하다고 느낀 적 있는가. 예쁜 카페, 감성적인 분위기, 고급 원두라는 말은 흔하다. 하지만 정말 이 커피가 어디서, 어떻게 만들어졌고, 내가 마신 이 맛이 다음에 와도
qclab.kr
2025.07.09 - [COFFEEPHARM QCLAB ] - DIRECTOR TJ - 소개 및 이력
DIRECTOR TJ - 소개 및 이력
ABOUT DIRECTOR TJinfo@coffeepharm.com 제약회사 품질관리(QC) 분야에서 10년 넘게 근무하고있는 전문가이자, 브랜드를 설계하고 스토리를 입히는 콘셉트 메이커다. #브랜딩 #제약품질관리 #커피품질관리 #
qclab.kr
#천안신상카페 #신방동데이트 #천안산책코스 #천안강변카페 #주차 편한 카페 #뷰맛집카페 #천안브런치맛집 #신방동감성카페 #천안카페 추천 #신방동핫플 #천안야외카페 #천안드라이브코스 #천안데이트카페 #천안강뷰카페 #천안야경카페 #천안 추천 카페 #신방동 추천 카페 #천안천카페 #천안신방동카페 #천안랜드마크카페 #천안 추천 #천안주차 편한 곳
'품질관리(Quality Control) > 이화학' 카테고리의 다른 글
| 10% (w/v) 수산화나트륨(NaOH) 용액 조제 방법(완결편) feat. 제약 품질 노트 (18) | 2025.08.25 |
|---|---|
| 10배 농축 PCR 버퍼 (10x PCR Buffer) 조제 방법 설명 (10) | 2025.08.25 |
| 왜 유리 피펫에는 액체가 남을까? 마지막 한 방울까지 비워야 하는걸까? 정답은... (4) | 2025.08.23 |
| 용액 농도 단위 총정리: 몰농도부터 ppm·ppb까지 정확한 활용법 (5) | 2025.08.22 |
| 분자량(Molecular Weight)과 몰질량(Molar Mass)의 차이 feat.제약 품질관리 노트 (9) | 2025.08.19 |
